RUS ENG
Грант Правительства РФ для государственной поддержки научных исследований, проводимых под руководством ведущих ученых в российских образовательных учреждениях высшего профессионального образования по договору № 11.G34.31.0065 от 19.10.2011 г.
Регенерация тканей дыхательных путей и легкого
Официальный сайт проекта "Исследование молекулярных механизмов и новых подходов в области регенеративной медицины для создания тканей дыхательных путей и легкого"
| |
| |
| |
| |
| |
| |
| |
О регенеративной медицине | |
| |
|
ТОП-10 успехов года
(Вольный перевод Романа Деева по версии Алексея Берсенева)
- Демонстрация безопасности при трансплантации клеток-дериватов эмбриональных стволовых клеток (ЭСК) при пигментной дегенерации сетчатки. Напомним, что первый протокол клинического исследования для этих клеток был разрешен в 2010 году – спустя 12 лет после открытия ЭСК. Теперь показано, что в течение 3 лет после транспалантаций никаких неблагоприятных событий не происходит. http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2814%2961376-3/abstract . ВНИМАНИЕ: данное исследование не отвечает на вопрос об эффективности методики!
- 90%-эффективность применения технологии CAR-генетической модификации Т-клеток для трансплантационного лечения резистентных гемобластозов. Важно, что данные результаты были подтверждены независимой научной группой.http://www.nejm.org/doi/full/10.1056/NEJMoa1407222
- Эффективность в долгосрочном периоде (4 года и более) пациентов с системной склеродермии после трансплантации аллогенных гемопоэтических клеток после иммуноабляции по сравнению с лечением циклофлосфомидом. Важно отметить, что в первый год выживаемость в группах сравнения почти не отличалась в связи с высокой токсичностью препаратов для кондиционирования; но если больному удавалось пережить этот рубеж, то прогноз существенно улучшался. Исследование проведено по программе 3 фазы с включением 156 пациентов из 10 стран. http://jama.jamanetwork.com/article.aspx?articleid=1883019
- ВАЖНО: показана безопасность коррекции гена CCR5 в гемопоэтических клетках при помощи технологии Zn-фингерных эндонуклеаз у пациентов с ВИЧ. Кроме того, показаны тенденции к эффективности данного подхода: у одного пациента после трансплантации модифицированных клеток не обнаружилась РНК вируса, а у 12 констатировано снижение титра.http://www.nejm.org/doi/full/10.1056/NEJMoa1300662
- Показана краткосрочная (3 года) безопасность ретровирусного вектора нового поколения для генной терапии у детей с SCID. У 7 из 9 пациентов были восстановлены функции Т-лимфоцитов. Однако, по мнению экспертов полную безопасность в отношении лейкозогенеза данная методика может продемонстрировать лишь через 10 лет наблюдений.http://www.nejm.org/doi/ref/10.1056/NEJMoa1404588#t=references
- Тканеинженерная вагина работает не менее 8 лет. Как показало исследование группы ученых под руководством Энтони Аталы, проведенное в Мексике с вовлечением 4 женщин. http://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2814%2960542-0/abstract
- Получены обнадеживающие результаты во 2 фазе исследования по лечению рассеянного склероза. Методика аналогична п. 3. С похожими тенденциями.
-
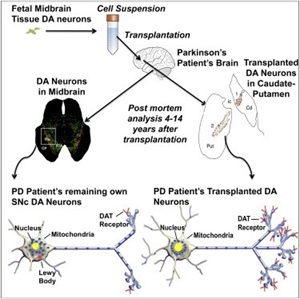 Показано выживание фетальный дофаминэргических нейронах в мозгу реципиентов с болезнью Паркинсона в течение 15-18 лет. Причем, долговременное выживание пересаженных клеток коррелировало с регрессом клинической симптоматики. http://www.cell.com/cell-reports/abstract/S2211-1247%2814%2900419-7
Показано выживание фетальный дофаминэргических нейронах в мозгу реципиентов с болезнью Паркинсона в течение 15-18 лет. Причем, долговременное выживание пересаженных клеток коррелировало с регрессом клинической симптоматики. http://www.cell.com/cell-reports/abstract/S2211-1247%2814%2900419-7 - Подтверждение технологии экспансии гемопоэтичских стволовых клеток пуповинной крови NiCord (Gamida Cell) и демонстрация безопасности/эффективности пересадки пациентам со злокачественным поражением костного мозга. Пожалуй, это исследование открывает новую страницу в трансплантации материала пуповинной крови.http://www.jci.org/articles/view/74556
- [Точнее данный материал считать не успехом, а полезной информацией]: очередная оценка результативности клеточной кардиопластики при помощи мононуклеаров и мульипотентных мезенхимальных стромальных клеток показала полную бесполезность первых, и заставила задуматься о целесообразности (а нужно ли городить огород?) вторых. http://jama.jamanetwork.com/article.aspx?articleid=1780025
[Таким образом, пока подтверждается наметившаяся тенденция прошлого года: простые технологии (выделил-размножил-ввел) не работают; генные технологии развиваются и возможно начнут занимать места в топах после закономерного выпадения от туда неуспешных клеточных; для клеточных технологий все контрастнее обособляются уникальные и безальтернативные ниши – замена тканей с клональным ростом – гемопоэтические при их злокачественном поражении, остальные апликации выглядят все более и более призрачными. Стоит обратить внимание на отсутствие успехов (по мнению эксперта) в деле воссоздания скелетных тканей, некоторое проседание клеточных продуктов для восстановления покровов и намечающаяся тенденция по замене их более дешевыми, но видимо не менее эффективными бесклеточными продуктами].
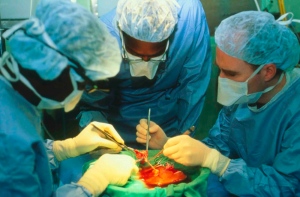
 Впервые выполнены четыре операции по пересадке влагалища, созданного из собственных тканей наружных половых органов пациенток. Результаты 4–8-летних наблюдений за прооперированными женщинами свидетельствуют об успешном восстановлении утраченной функции органов и опубликованы в журнале «Lancet»
Впервые выполнены четыре операции по пересадке влагалища, созданного из собственных тканей наружных половых органов пациенток. Результаты 4–8-летних наблюдений за прооперированными женщинами свидетельствуют об успешном восстановлении утраченной функции органов и опубликованы в журнале «Lancet»
Потребность в вагинальной реконструкции возникает при врожденных аномалиях, травмах или онкозаболеваниях. Методы реконструкции с использованием тканей кишечника или кожи разработаны, но они часто сопряжены с серьезными осложнениями. Ученые из Института регенеративной медицины города Уэйк-Форест (США) использовали для воссоздания вагинальной части детородного органа собственные клетки вульвы пациенток.
В пилотном исследовании приняли участие четыре девушки в возрасте от 13 до 18 лет. Все они страдали редким генетическим заболеванием — синдромом Майер — Рокитанского — Кустер — Хаузер (сокращенно СМРКХ). Это наследственный порок развития, при котором нормально развиваются и функционируют яичники, наблюдается полноценное формирование вторичных половых признаков, но совершенно не сформированы тело матки и влагалище.

У каждой пациентки брали немного клеток вульвы (наружных половых органов), помещали в стерильные условия на питательную среду. Клетки делились, а через четыре недели, когда нарабатывалось достаточное количество материала, клетки высевали на биоразлагаемый полимерный «каркас» органа и доращивали еще две недели. Поскольку ткань влагалища состоит из мышечных клеток, снаружи выстланных эпителиальными, ученые готовили специальную слоистую структуру, чтобы сохранить архитектуру этих специализированных клеток.
В течение шести недель после операции имплантированную ткань поддерживали с помощью стентов. Полимерная основа биоинженерной ткани полностью исчезала через несколько месяцев после операции, а искусственное влагалище начинало нормально функционировать, выделяя слизи и смазки, гладкие мышцы сокращались безболезненно.
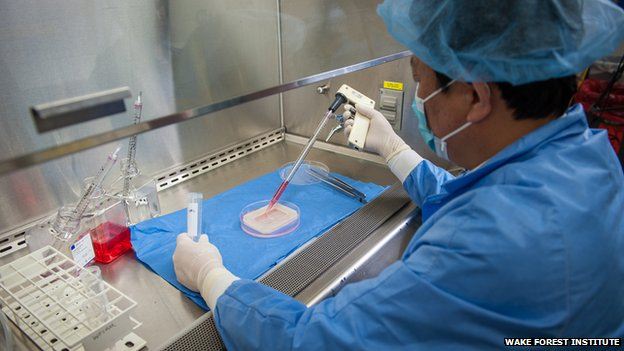
Результаты работы исследователи долгое время не публиковали, чтобы оценить долгосрочные результаты трансплантации. Пациентки находились под наблюдением от четырех до восьми лет. По словам ученых, у девушек появилась надежда зачать и родить здоровых детей, и для этого теперь есть все шансы.
sci-hub.org/downloads/1d30/raya-rivera2014.pdf
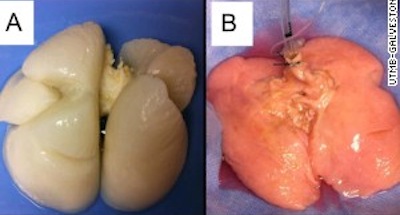 Ученым впервые удалось создать человеческое легкое в лабораторных условиях, что, безусловно, является прорывом в области регенеративной медицины.
Ученым впервые удалось создать человеческое легкое в лабораторных условиях, что, безусловно, является прорывом в области регенеративной медицины.
“Это невероятно”, – говорит Джоан Николс (Joan Nichols), исследователь Медицинского Центра Университета Техаса (University of Texas Medical Branch). “Когда-то подобное могло быть лишь в научной фантастике, а теперь становится частью реальной жизни”.
Если легкие будут работать – а в данном случае союз если опускать нельзя – это помогло бы более, чем 1600 пациентам (в США), ожидающим трансплантации.
Джоан Николс (Joan Nichols) из Медицинского Центра Университета Техаса (University of Texas Medical Branch), где было проведено исследование, сообщила, что в исследованиях были использованы легкие двоих детей, погибших от ранений, полученных в автомобильной катастрофе. Из-за повреждений органы были не пригодны для трансплантации, однако часть тканей остались нетронутыми.
Ученые очистили одно из легких практически от всего клеточного материала, сохранив только каркас из коллагена и эластина.
Следующим шагом стало засеивание каркаса клетками, полученными со второго легкого. Далее этот каркас был помещен в большую камеру, наполненную жидкостью, которая, по словам г-жи Николс, по виду напоминала напитки типа Кулэйд, а в действительности давала питательные вещества для роста клеток. Спустя примерно четыре недели появилось искусственно созданное человеческое легкое.
Эксперимент был повторен на легких еще двоих погибших детей.
- Легкие, созданные в лабораторных условиях, очень похожи на настоящие, они лишь чуть более розовые, мягкие и менее плотные, - говорит Николс.
Она также предположила, что пройдет еще примерно 12 лет прежде, чем такие органы можно будет использовать в клинике.
“Этим будут заниматься уже мои студенты, когда я постарею, выйду на пенсию и не смогу больше держать в руках пипетку”, – говорит она.
На фото: легкое до и после засеивания.
Нобелевская премия 2013 года в области Физиологии и медицины присуждена: Джеймсу Ротману, Рэнди Шекману и Томасу Зюдхофу за открытия в области исследования транспортной системы в клетках
В 2013 году Нобелевскими лауреатами стали трое ученых, которым удалось разгадать загадку внутриклеточной транспортной системы. Каждая клетка является своеобразной фабрикой по производству и экспорту молекул. Таким образом вырабатывается и выбрасывается в кровь инсулин, и химические сигналы, называемые нейромедиаторами, передаются от одной нервной клетки к другой. Транспортировка этих молекул осуществляется в небольших «упаковках», называемых везикулами. Трем Нобелевским лауреатам удалось выявить молекулярные принципы, которые управляют процессом переноса этого «груза» для своевременной доставки в нужный участок клетки.
Рэнди Шекман открыл набор генов, необходимых для осуществления движения везикул. Джеймс Ротман обнаружил белковый механизм, который позволяет пузырькам соединяться с так называемыми мишенями для обеспечения переноса «груза». Томас Зюдхоф выявил, каким образом пузырьки направляются именно в необходимый участок клетки.
Открытия Ротмана, Шекмана и Зюдхофа проливают свет на удивительно точную систему контроля транспортировки и доставки клеточного «груза». Нарушения этой системы могут оказывать губительный эффект и вызвать диабет, ряд неврологических и иммунологических заболеваний.
Как происходит доставка «груза»
В работе крупного порта крайне важно, чтобы транспортная система обеспечивала своевременную доставку груза в нужном направлении. Клетка, с ее различными составляющими, так называемыми органеллами, сталкивается с такой же проблемой: клетки производят такие молекулы как гормоны, нейромедиаторы, цитокины и ферменты, которые необходимо в определенный момент доставить в другие части клетки или вывести из нее. Время и локализация играют крайне важную роль. Небольшие везикулы, внешне напоминающие пузырьки и окруженные мембранами, курсируют между органеллами или соединяются с внешними мембранами клеток и выводят свой «груз» из клетки. Этот процесс крайне важен, так как он запускает нервную активацию в случае с медиаторными веществами и контролирует метаболизм в случае с гормонами. Каким образом везикулы понимают, куда и когда необходимо доставить этот «груз»?
Генетический контроль нарушений транспортировки
 Рэнди Шекман был крайне впечатлен системой организации внутриклеточной транспортировки и еще в 1970-ых решил исследовать генетическую основу данного процесса, использовав дрожжи в качестве модели. Генетический анализ выявил, что в результате нарушений механизмов транспортировки в дрожжевых клетках возникало нечто подобное ситуации плохо организованной системы общественного транспорта. Везикулы скапливались только в определённых частях клетки. Он также обнаружил, что причины данного явления носили генетический характер и продолжил исследования, чтобы выявить мутировавшие гены. Шекман выделил три класса генов, которые контролируют различные аспекты внутриклеточной транспортировки, тем самым объяснив тщательно регулируемый механизм, который осуществляет внутриклеточную транспортировку.
Рэнди Шекман был крайне впечатлен системой организации внутриклеточной транспортировки и еще в 1970-ых решил исследовать генетическую основу данного процесса, использовав дрожжи в качестве модели. Генетический анализ выявил, что в результате нарушений механизмов транспортировки в дрожжевых клетках возникало нечто подобное ситуации плохо организованной системы общественного транспорта. Везикулы скапливались только в определённых частях клетки. Он также обнаружил, что причины данного явления носили генетический характер и продолжил исследования, чтобы выявить мутировавшие гены. Шекман выделил три класса генов, которые контролируют различные аспекты внутриклеточной транспортировки, тем самым объяснив тщательно регулируемый механизм, который осуществляет внутриклеточную транспортировку.
Точное соединение
 Джеймс Ротман был также заинтересован природой системы клеточной транспортировки. При изучении транспортировки везикул в клетках млекопитающих в 1980ых и 1990ых, Ротман обнаружил, что белковые комплексы позволяют везикулам соединяться с целевыми мембранами. В процессе соединения белки и целевые мембраны связываются друг с другом как половинки застежки типа «молния». Тот факт, что существует целый ряд таких белков, и они соединяются только в определенные комбинации, позволяет предположить, что «груз» доставляется только в конкретные участки. Тот же принцип действует внутри клетки, и когда везикула соединяется с внешней мембраной клетки для высвобождения ее содержимого.
Джеймс Ротман был также заинтересован природой системы клеточной транспортировки. При изучении транспортировки везикул в клетках млекопитающих в 1980ых и 1990ых, Ротман обнаружил, что белковые комплексы позволяют везикулам соединяться с целевыми мембранами. В процессе соединения белки и целевые мембраны связываются друг с другом как половинки застежки типа «молния». Тот факт, что существует целый ряд таких белков, и они соединяются только в определенные комбинации, позволяет предположить, что «груз» доставляется только в конкретные участки. Тот же принцип действует внутри клетки, и когда везикула соединяется с внешней мембраной клетки для высвобождения ее содержимого.
Оказалось, что некоторые из генов, которые открыл Шекман при работе с дрожжами, кодировали белки, соответствовавшие тем, которые Ротман выявил в организмах млекопитающих, что проливало свет на эволюционное происхождение транспортной системы. Вместе они определили компоненты, ответственные за механизмы внутриклеточной транспортировки.
Временная регуляция
 Томас Зюдхоф занимался изучением взаимодействия нервных клеток в мозге. Сигнальные молекулы, нейромедиаторы, высвобождаются при соединении везикул с внешней мембраной нервных клеток, согалсно механизму, открытому Ротманом и Шекманом. Однако эти везикулы способны высвобождать свое содержимое только тогда, когда нервная клетка подает сигнал своим соседям. Как осуществляется столь точная регуляция этого высвобождения? Было известно, что в этом принимают участие ионы кальция, и в 1990ых Зюдхоф занялся поиском чувствительных к кальцию белков в нервных клетках. Он выявил молекулярный механизм, реагирующий на поступление ионов кальция и направляющий соседние белки для связывания с внешней мембраной нервной клетки. «Застежка» раскрывается, и происходит высвобождение сигнальных веществ. Открытие Зюдхофа объяснило, за счет чего достигается временная точность, и каким образом содержимое везикулы высвобождается именно тогда, когда это нужно.
Томас Зюдхоф занимался изучением взаимодействия нервных клеток в мозге. Сигнальные молекулы, нейромедиаторы, высвобождаются при соединении везикул с внешней мембраной нервных клеток, согалсно механизму, открытому Ротманом и Шекманом. Однако эти везикулы способны высвобождать свое содержимое только тогда, когда нервная клетка подает сигнал своим соседям. Как осуществляется столь точная регуляция этого высвобождения? Было известно, что в этом принимают участие ионы кальция, и в 1990ых Зюдхоф занялся поиском чувствительных к кальцию белков в нервных клетках. Он выявил молекулярный механизм, реагирующий на поступление ионов кальция и направляющий соседние белки для связывания с внешней мембраной нервной клетки. «Застежка» раскрывается, и происходит высвобождение сигнальных веществ. Открытие Зюдхофа объяснило, за счет чего достигается временная точность, и каким образом содержимое везикулы высвобождается именно тогда, когда это нужно.
Внутриклеточная транспортировка проливает свет на механизмы заболеваний
Трое Нобелевских лауреатов раскрыли фундаментальный процесс клеточной физиологии. Эти открытия оказали огромное влияние на понимание того, как осуществляется доставка «груза» внутри и за пределами клетки. Везикулярная транспортировка и соединение осуществляются по единому общему принципу в столь разных организмах как дрожжи и человек. Эта система является неотъемлемой для ряда физиологических процессов, в которых необходимо контролирование процесса соединения, от подачи сигналов в мозге до выделения гормонов и иммуноцитокинов. Нарушения внутриклеточной транспортировки выявляются при различных заболеваниях, включая ряд неврологических и иммунологических заболеваний, а также при диабете. Без этой удивительно точной организации, в клетках бы происходил хаос.
Джеймс Ротман родился в 1950 в г.Хейверхилл, Массачусетс, США. Получил ученую степень в Гарвардской медицинской школе в 1976 году, обучался в постдокторантуре Массачусетского технологического университета, а в 1978 году стал сотрудником Стэнфордского университета Калифорнии, где он начал проводить исследования функционирования клеточных везикул. Ротман также работал в Принстонском университете, Раковом Интституте Слоун-Кеттеринг и Университете Колумбии. В 2008 году стал сотрудником профессором факультета, а также заведующим кафедрой клеточной биологии Йельского университета в городе Нью-Хэвен, Коннектикут, США.
Рэнди Шекман родился в 1948 году в городе Сент-Пол, Миннесота, США. Обучался в Университете Калифорнии в Лос-Анджелесе и Стэнфордском университете, где получил ученую степень в 1974 году под руководством Артура Корнберга (Нобелевская премия 1959) на той же кафедре, сотрудником которой стал Ротман несколькими годами позже. В 1976 году, Шекман стал сотрудником Университета Калифорнии в Беркли, где он и по сей день является профессором кафедры молекулярной и клеточной биологии. Шекман также является исследователем Медицинского института Говарда Хьюза.
Томас Зюдхоф родился в 1955 году в городе Гёттинген, Германия. Обучался в Гёттингенском университете, где получил ученую степень в 1982 году и в этом же году ему было присвоено звание доктора наук в области нейрохимии. В 1983 году он поступил в постдокторантуру Юго-западного медицинского центра Техасского Университета в Далласе, Техас, США, с Майклом Брауном и Джозефом Гольдштайном (Лауреаты Нобелевской премии 1985 года в области Физиологии и медицины). В 1991 году Зюдхоф стал исследователем Медицинского института Говарда Хьюза, а в 2008 году стал Профессором Молекулярной и клеточной физиологии Стэнфордского университета.
 Человеческая печень выращена в организме мыши. Последние исследования показали, что трансплантация предшественников ткани печени из стволовых клеток человека способствует восстановлению функции этого органа у мышей. Хотя результаты исследований предварительные, они уже позволяют говорить о развитии потенциально новых подходов к лечению пациентов, ожидающих трансплантации печени. Имплантированные «зачатки» печени, размером 4 мм, предотвратили гибель мышей с печеночной недостаточностью, сообщается 3 июля в исследовательском отчёте журнала Nature.
Человеческая печень выращена в организме мыши. Последние исследования показали, что трансплантация предшественников ткани печени из стволовых клеток человека способствует восстановлению функции этого органа у мышей. Хотя результаты исследований предварительные, они уже позволяют говорить о развитии потенциально новых подходов к лечению пациентов, ожидающих трансплантации печени. Имплантированные «зачатки» печени, размером 4 мм, предотвратили гибель мышей с печеночной недостаточностью, сообщается 3 июля в исследовательском отчёте журнала Nature.
Трансплантированные структуры также взяли на себя ряд функций печени – выработку тканеспецифичных белков и специфических для человеческого организма метаболитов. Но более важен тот факт, что происходила быстрая васкуляризация имплантов, которые продолжали расти и после трансплантации.
Результаты предварительные, но многообещающие, говорит Валери Гийон-Эванс (Valerie Gouon-Evans), которая изучает органогенез и регенерацию печени в Больнице Маунт-Синай (Mount Sinai Hospital) в Нью-Йорке. «Это нечто абсолютно новое», - говорит она. Поскольку зачатки печени поддерживаются кровеносной системой реципиента, имплантированные клетки продолжают пролиферировать и осуществлять функции этого органа.
Однако, по ее словам, за животными, перенесшими трансплантацию, необходимо осуществлять наблюдение в течение нескольких месяцев, чтобы проверить, не начнут ли клетки вырождаться или превращаться в опухолевые.
В настоящее время в мире наблюдается острая нехватка донорских органов для трансплантации печени. В 2011 году только в США было проведено 5,805 трансплантаций печени взрослым. В том же году 2,938 человек умерли в ожидании донорского органа или становились слишком слабы, чтобы оставаться в листе ожидания.
Путь создания сложных органов в лабораторных условиях оказался, однако, довольно тернист. Таканори Такэбэ (Takanori Takebe), биолог, занимающийся изучением стволовых клеток в Университете Иокогамы (Yokohama City University) в Японии, один из руководителей исследования, считает, что это первый случай, когда в лаборатории удалось создать цельный орган с использованием индуцированных плюрипотентных стволовых клеток.
По словам Такэбэ, проведение клинических исследований в ближайшем будущем не предвидится. Помимо того, что необходимы длительные испытания на животных, в настоящее время создание материала в количествах, требуемых для трансплантации в человеческий организм, не представляется возможным.
В проведенном исследовании Такэбэ имплантировал предшественники печеночной ткани в полость черепа и в брюшную полость. В будущем он надеется создать «зачатки» настолько малого размера, чтобы существовала возможность внутривенного введения в организм мыши и, возможно, человека. Он также надеется имплантировать их непосредственно в печень, где они могли бы образовывать желчные протоки, необходимые для правильного пищеварения, которые, однако, в последних исследованиях не изучались.
Самоорганизующиеся структуры
Исследователи моделируют развитие печени из трех типов человеческих клеток. В первую очередь, они направляют развитие индуцированных плюрипотентных стволовых клеток в тот тип клеток, который экспрессирует печеночные гены. Затем они добавляют эндотелиальные клетки (которые покрывают кровеносные сосуды с внутренней стороны), полученные из пуповинной крови, и мезенхимальные стволовые клетки, которые способны образовывать кости, хрящи и жир. Все эти типы клеток встречаются в процессе формирования печени при развитии эмбриона.
«Это великий день для онтогенетики», - говорит Кеннет Зарет (Kenneth Zaret), занимающийся изучением регенеративной медицины и органогенезом печени в Университете Пенсильвании (University of Pennsylvania) в Филадельфии. «Посредством воспроизведения клеточных взаимодействий, важных для естественного развития печени, они получают довольно здоровую и зрелую ткань».
По словам Такэбэ, этот проект стартовал благодаря неожиданному явлению. В надежде найти способ васкуляризации печеночной ткани, он пытался культивировать многочисленные типы клеток вместе и заметил, что они начинают самоорганизовываться в трехмерные структуры. С того момента были проведены сотни экспериментов по моделированию развития печени с регулированием параметров зрелости и количества клеток.
Другие органы
Данный метод занимает промежуточное положение между двумя основными подходами регенеративной медицины. В случае простых, полых органов, таких как мочевой пузырь и трахея, исследователи засеивают каркасы живыми клетками, а затем трансплантируют орган пациенту. Также в настоящий момент ученые в лабораторных условиях получили монокультуры функциональных клеток с целью введения в организм пациента, где бы они могли самостоятельно развиваться. Однако, даже если клетки хорошо развивались в лабораторных условиях, говорит Гийон-Эванс, процесс забора клеток может повредить их и нарушить функционирование.
Зарет считает, что эксперименты по моделированию развития печени могут дать начало промежуточному подходу. «Принцип следующий: поместить клетки в одно пространство и дать им возможность взаимодействовать и сформировать орган».
Также проводятся эксперименты с самоорганизующимися структурами из стволовых клеток также для других систем органов, таких как зрительных бокал, который представляет собой раннюю стадию развития глаза2. Также в лабораторных условиях были выращены мини-кишки с использованием только стволовых клеток человека3.
По убеждению Такэбэ, «самоорганизационный подход» может быть применим и к другим органам, таким как легкие, поджелудочная железа и почки.
Журнал:
http://www.nature.com/news/miniature-human-liver-grown-in-mice-1.13324
 Американские биологи впервые вырастили полноценную искусственную почку, способную исполнять все функции ее природного аналога, и успешно пересадили ее в тело крысы, сообщает журнал Nature Medicine.
Американские биологи впервые вырастили полноценную искусственную почку, способную исполнять все функции ее природного аналога, и успешно пересадили ее в тело крысы, сообщает журнал Nature Medicine.
"Что является уникальным в нашей методике — мы сохраняем "архитектуру" почки больного, в результате чего мы можем просто пересадить новую почку и подключить ее к кровеносной и мочеполовой системе. Если нам удастся адаптировать ее для выращивания человеческих почек, пациенты, которые сейчас ждут подходящих доноров, смогут получить новые органы, выращенные из их собственных клеток", — заявил Гаральд Отт (Harald Ott) из Гарвардского университета (США).
Отт и его коллеги вырастили искусственную почку при помощи оригинальной методики, использующей больную почку пациента в качестве "шаблона" для сборки ее исправной копии. По методике Отта, поврежденный орган сначала обрабатывается комбинацией химикатов, которые уничтожают клетки и оставляют обрамляющие их соединительные белки.
Затем этот "шаблон" заполняется через бывшие артерии и мочевыводящие пути "заготовками" клеток почки и сосудов, извлеченными из зародыша крысы. Постепенно меняя давление, температуру и химический состав питательной среды, ученые добились того, что большая часть этих клеток проникла внутрь "шаблона" и закрепилась в "ячейках", где раньше обитали клетки грызуна. Через несколько недель заготовка превратилась в полноценный орган, пропускающий через себя кровь и выделяющий мочу.
Удостоверившись в том, что искусственная почка не страдала от утечек крови и вырабатывала нормальную по своему составу мочу, ученые пересадили ее в тело крысы. Операция завершилась удачно — организм крысы не отторг почку и начал использовать ее по назначению. Как отмечают биологи, искусственный орган пока не так эффективен, как его природный аналог. Отт и его коллеги связывают это с тем, что почечные клетки зародыша крысы не были достаточно зрелыми для работы во взрослой почке.
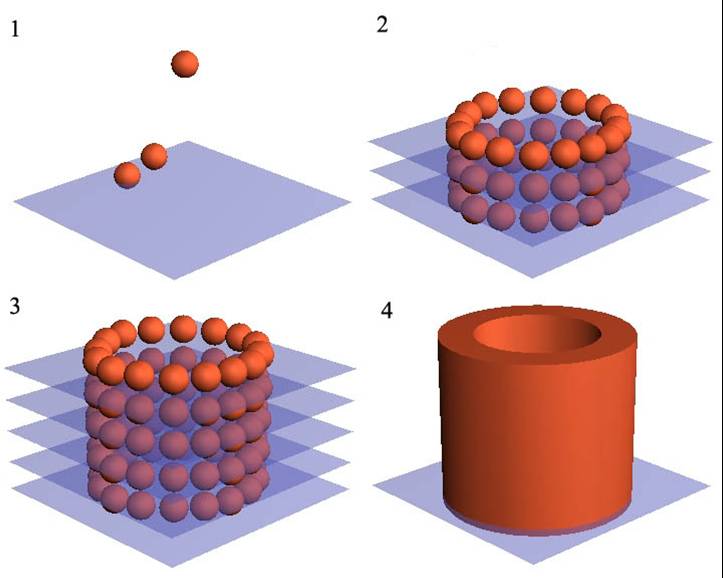
 День регенеративной медицины в Сколково. По инициативе Инноцентра Сколково 14 февраля 2013 года был объявлен "Днем регенеративной медицины в России". В Hypercube Сколково выступили ученые, составляющие ядро мировой регенеративной медицины.
День регенеративной медицины в Сколково. По инициативе Инноцентра Сколково 14 февраля 2013 года был объявлен "Днем регенеративной медицины в России". В Hypercube Сколково выступили ученые, составляющие ядро мировой регенеративной медицины.
Конференция, посвященная регенеративной медицине – дисциплине на стыке биологии, медицины, физики, химии – проходила под эгидой российской компании 3D bioprinting solutions (генеральный директор Александр Островский, председатель совета директоров группы компаний ИНВИТРО).
Группа ученых компании под руководством пионера технологии биопринтинга органов, автора первой в мире научной публикации о биопечати органов Владимира Миронова (Vladimir Mironov), в настоящее время профессора Университета Содружества Виргинии, США, уже работает над технологией трехмерной печати органов и тканей из аутологичных клеток человека. Поскольку аутологичные клетки взяты у самого пациента, такая технология может стать решением проблемы иммунной совместимости, а со временем открыть возможность получения недорогих прототипов органов и эффективных способов тканезамещения.
На Дне регенеративной медицины в Сколково Владимир Миронов выступил с докладом о том, что такое биопринтинг, каковы нерешенные вопросы этой технологии и рассказал об уже реализованных проектах. В частности, об аппарате для производства тканевых сфероидов и о запатентованной технологии изготовления сосудистых протезов из нано-волокон. Первые простые органы будут напечатаны к 2030 году, заявил Миронов на пресс-конференции в «Сколково». Такие сроки называет Национальный разведывательный совет США.
3D-биопечать – это сравнительно новая и динамично развивающаяся область медицины. Суть технологии в том, что в 3D-принтер наливаются клетки и в соответствии с компьютерной моделью их слой наносится на специальную tarповерхность, а затем послойно выстраивается 3D-объект – орган. 3D-биопечать родственна технологии 3D-печати, когда почти любую вещь можно создать с помощью специальных принтеров. По словам Гелены Лифшиц, директора по медицине кластера Биомед«Сколково», уже сейчас мотоцикл, который может ездить, печатается за несколько дней. Задача 3D-биопечати – создание «запчастей» для человека, говорит Александр Островский из группы компаний Invitro. «Медицина постоянно дорожает, и если не найдётся выхода из ситуации, то через какое-то время счета могут достичь астрономической суммы» – отмечает он.
 Биопринтинг является весьма впечатляющим, но не единственным из направлений регенеративной медицины,. Время покажет, какая технология окажется наиболее эффективной, скорее всего это будет симбиоз различных подходов, либо отдельные решения для определенных органов и типов тканей. Примеры таких подходов были представлены профессором регенеративной медицины Каролинского Института (Швеция), победителем конкурса мегагрантов РФ 2011 г. Паоло Маккиарини (Paolo Macchiarini). Маккиарини разработал, в частности, технологию выращивания трахеи для трансплантации и в рамках мегагранта провел первую в мире трансплантацию трахеи и части гортани с использованием собственных клеток пациента..
Биопринтинг является весьма впечатляющим, но не единственным из направлений регенеративной медицины,. Время покажет, какая технология окажется наиболее эффективной, скорее всего это будет симбиоз различных подходов, либо отдельные решения для определенных органов и типов тканей. Примеры таких подходов были представлены профессором регенеративной медицины Каролинского Института (Швеция), победителем конкурса мегагрантов РФ 2011 г. Паоло Маккиарини (Paolo Macchiarini). Маккиарини разработал, в частности, технологию выращивания трахеи для трансплантации и в рамках мегагранта провел первую в мире трансплантацию трахеи и части гортани с использованием собственных клеток пациента..
Среди докладчиков 14 февраля был также профессор Сюэцзюнь Вэнь (Xuejun Wen), Университет Содружества Виргинии, который рассказал о компьютеризированном создании тканей в регенеративной медицине.
Главными темами дня в панельных дискуссиях стали состояние регенеративной медицины в мире и в России, ее развитие, основные участники процесса и тенденции. По проблеме частных инвестиций в эту наукоемкую отрасль выступил профессор Высшей школы экономики Геннадий Константинов. Его доклад продолжился панельной дискуссией с участием представителей Фонда содействия развитию малых форм предприятий в научно-технической сфере (Фонд Ивана Бортника), Российской венчурной компании, создателя Фонда "Наука за продление жизни" Михаила Батина и других экспертов.
 3-5 декабря 2012 года состоялся ежегодной Всемирный Саммит по Стволовым Клеткам - всеобъемлющее, знаковое событие для регенеративной медицины. Крупнейшее междисциплинарное событие объединило все заинтересованные стороны и способствовало установлению деловых контактов.
Саммит является единственной в мире организацией в области регенеративной медицины, которая ставит цели продвижения биомедицинских исследований, финансирования и инвестиционных вложений и строит планы на будущее.
3-5 декабря 2012 года состоялся ежегодной Всемирный Саммит по Стволовым Клеткам - всеобъемлющее, знаковое событие для регенеративной медицины. Крупнейшее междисциплинарное событие объединило все заинтересованные стороны и способствовало установлению деловых контактов.
Саммит является единственной в мире организацией в области регенеративной медицины, которая ставит цели продвижения биомедицинских исследований, финансирования и инвестиционных вложений и строит планы на будущее.
Средства массовой информации уделили должное внимание участникам Саммита. Паоло Маккиарини из Каролинского института (представивший пленарную лекцию "Трансплантация Органов и Клеточная Терапия, в основе которых лежит использование стволовых клеток"), был отмечен в Нью-Йорк Таймс как доктор, совершивший первую в своем роде пересадку биоискусственного органа. Сьюзан Соломон из Нью-йоркской Организации по Стволовым Клеткам получила более чем 17000 просмотров Talk TED "Реализация перспектив исследований в области стволовых клеток", и Джордж Дэйли из педиатрической клиники Бостона и Гарвардского Университета дал интервью Национальному Общественному Радио под заголовком "Ученые создают из стволовых клеток мыши яйцеклетки, способные к оплодотворению ". Об авторах.
В контексте предусмотренных программой Саммита необходимых экономических и социальных условий, а также человеческих ресурсов для исследований пришло понимание того, как все части головоломки в области стволовых клеток складываются в общую картину. Более 150 докладчиков приняли участие в конференции, представив исчерпывающие презентации общим объемом 50 часов.
Ключевые направления Саммита 2012: раковые заболевания, диабет; ВИЧ / СПИД; сердечно-сосудистые заболевания; повреждения спинного мозга, паралич, болезнь Паркинсона и другие неврологические заболевания, офтальмологические болезни и т.д.
Междисциплинарная программа Всемирного Саммита по Стволовым Клеткам 2012 представила наиболее актуальных темы в заявленной области исследования по четырем направлениям:
1. 1) Фундаментальные исследования
2. 2) Трансляция и регулирование
3. 3) Коммерциализация и Возмещение расходов
4. 4) Юридическая поддержка \ безопасность потребителей.
В дополнение к ключевым лекциям и секционным дискуссиям в насыщенную трехдневную программу саммита были включены: круглые столы Expert Lunch; Выставочный Зал; Poster Forum, демонстрирующий избранный курс научных исследований; церемония награждения и обед Stem Cell Action Awards Dinner, а также создание сети потенциальных партнерских отношений.
Poster Forum объединил ученых и исследователей, представителей фондов, финансирующих исследования; членов организаций экономического развития, участников сообществ Institutional Review Boards and Stem Cell Research Oversight; организации по защите прав пациентов, самих пациентов и представителей соответствующих некоммерческих организаций; государственные учреждения здравоохранения и их коллег по всему миру, представителей страховых и финансовых структур; преподавателей и студентов, изучающих медицину, физиологию, биологию, этику, право , а также другие дисциплины, связанные с социальным применением, и практикующих специалистов. Алан Джакимо, Сениор Каунсел, Сидлей Остин объявили победителей Poster Forum Всемирного Саммита по Стволовым Клеткам. Трое победителей были выбраны в номинациях Наука, Технология и Индустрия; один - в номинации Юридическая поддержка, Образование и Участие в Общественной Деятельности. А также, один участник получил Студенческую Премию за самый креативный и инновационный доклад, представленный студентом Высшей Школы или студентом Колледжа последнего года обучения.
Победители получили право опубликовать свои исследования в журнале Regenerative Medicine. Обладателю первого места в общем зачете представится возможность выбора бесплатной регистрации на Всемирном Саммите по Стволовым Клеткам 2013 либо $ 500, участники, занявшие второе и третье места, получат по $ 250, четвертое и пятое места - по $ 100.
После оглашения призовых мест Алан Джакимо сказал: "Доклады на конференциях в любой сфере - как новые методы лечения в здравоохранении – символ надежды. Основываясь на докладах Саммита этого года, можно сказать, что в нашем распоряжении есть многое, на что можно возлагать надежды".
Нобелевская премия в области физиологии и медицины 2012 г. присуждена Джону Гардону (John B. Gurdon), институт Gurdon, Кэмбридж, и Синье Яманаке (ShinyaYamanaka), Kyoto University, Япония, за работы в области стволовых клеток и клонирования животных. Ученые обнаружили, что клетки взрослого организма способны заново развиваться.
Открытия, удостоенные премии The Nobel Assembly в Каролинском институте в Стокгольме, дали дорогу исследованиям в различных областях: от регенеративной медицины до лечения онкологических заболеваний. “Gurdon and Yamanaka в корне изменили наши представления о дифференциации клеток,”- говорит George Daley, директор программы Трансплантация Стволовых Клеток Гарвардской Медицинской Школы. - Ученые разъяснили, что вектор развития клетки может быть ремоделирован. Таким образом, взрослая клетка может быть возвращена в свое эмбриональное состояние. Данная концепция сдвига парадигм открыла большое количество направлений и возможностей для новых исследований”.

 По мнению многих ученых, Gurdon не зря является “крестным отцом клонирования”. В 1962 году, опубликовав знаковое исследование в Журнале Эмбриологии и Экспериментальной Морфологии, он показал следующее: имплантация ядер клеток взрослой лягушки в яйцеклетку лягушки, из которой предварительно было удалено ядро, могло привести к появлению функционирующего, клонированного головастика. Эксперимент о процессе клеточного репрограммирования у лягушек, в то время подвергшийся широкой критике, тем не менее, явился прорывом в области клонирования. В конечном счете, это привело к созданию знаменитой овцы Dolly, в 1996 году. Результаты первого эксперимента по перемещению ядер привели к осознанию того, что взрослые клетки могут заново приобретать способность к эмбриональному развитию. По данной концепции это осуществимо даже при условии достижения клетками предназначенной дифференцировки. Однако оставался вопрос, могут ли интактные клетки быть перепрограммированы на достижение плюрипотентного состояния, что тем самым давало бы им способность развиваться в другие типы клеток организма. Ответ был получен спустя сорок лет, когда ShinyaYamanaka обнаружил существование четырех генов, способных перепрограммировать дифференцированную клетку мыши в клетку, которая бы обладала универсальностью эмбриональной. В первые дни развития плюрипотентные эмбриональные стволовые клетки дают начало клеткам организма, включая клетки кожи, кишечника и мозга. Опыт Yamanaka показал, что интактные взрослые клетки могут быть перезагружены в те, что сейчас известны как индуцированные плюрипотентные клетки (iPS), которые, как и эмбриональные стволовые клетки, могут давать рост разным типам клеток.
По мнению многих ученых, Gurdon не зря является “крестным отцом клонирования”. В 1962 году, опубликовав знаковое исследование в Журнале Эмбриологии и Экспериментальной Морфологии, он показал следующее: имплантация ядер клеток взрослой лягушки в яйцеклетку лягушки, из которой предварительно было удалено ядро, могло привести к появлению функционирующего, клонированного головастика. Эксперимент о процессе клеточного репрограммирования у лягушек, в то время подвергшийся широкой критике, тем не менее, явился прорывом в области клонирования. В конечном счете, это привело к созданию знаменитой овцы Dolly, в 1996 году. Результаты первого эксперимента по перемещению ядер привели к осознанию того, что взрослые клетки могут заново приобретать способность к эмбриональному развитию. По данной концепции это осуществимо даже при условии достижения клетками предназначенной дифференцировки. Однако оставался вопрос, могут ли интактные клетки быть перепрограммированы на достижение плюрипотентного состояния, что тем самым давало бы им способность развиваться в другие типы клеток организма. Ответ был получен спустя сорок лет, когда ShinyaYamanaka обнаружил существование четырех генов, способных перепрограммировать дифференцированную клетку мыши в клетку, которая бы обладала универсальностью эмбриональной. В первые дни развития плюрипотентные эмбриональные стволовые клетки дают начало клеткам организма, включая клетки кожи, кишечника и мозга. Опыт Yamanaka показал, что интактные взрослые клетки могут быть перезагружены в те, что сейчас известны как индуцированные плюрипотентные клетки (iPS), которые, как и эмбриональные стволовые клетки, могут давать рост разным типам клеток.
Открытие 2006 года, опубликованное в Cell, предоставляет исследователям генетическим рецепт для создания iPS клеток из зрелых клеток у мышей и человека. С момента данного открытия другие ученые пытались создать iPS клетки у людей. Эти iPS клетки позволяют исследователям изучать болезнь и ее развитие в лаборатории, например, генерировать модели болезни из кожи пациентов с нейродегенеративными расстройствами. Кроме того, iPS клетки перспективны в заместительной клеточной терапии для лечения различных заболеваний. “Индуцированные плюрипотентные стволовые клетки уже начали революцию в медицине”,- говорит Paul Fairchild, директор Оксфордского института Стволовых Клеток. Они способны обеспечить “столь необходимые модели редких и сложных заболеваний, путем формирования ресурсов клеток, тех, что однажды могут быть использованы для замены изношенных, либо находящихся под угрозой дегенеративных заболеваний”. “Премия - это то, что приходит не сразу, говорит Magdalena Zernicka-Goetz, институт Gurdon, Кембридж, - я думаю, мы все ожидали ее определенный период времени.”
Третий Всемирный конгресс по тканевой инженерии и регенеративной медицине (5-8 сентября 2012, Вена, Австрия) собрал около 3000 ученых со всего мира (всего 10 участников из России), представляющих разные области науки – от клеточной биологии до информатики. Научная программа включала более 300 устных докладов и 1500 постерных. Она отразила быстрый прогресс, достигнутый в области регенеративной медицины за последние три года, после предыдущего Всемирного конгресса.
А также – растущее политическое и общественное влияние этого симбиоза фундаментальных исследований, высоких технологий и клиники. Не случайно конгресс проходил в президентском дворце Hofburg.
За последние три года численность этой научной ассоциации возросла почти вдвое (до 4000) с примерно равным распределением по регионам – Северная Америка, Европа и Юго-Восточная Азия.
 Отличительная особенность нынешнего конгресса: рекордное количество докладов, посвященных трансляционным исследованиям, внедрению фундаментальных научных результатов в клинику. По крайней мере, четыре полноценных самостоятельных секции были организованы специально для обсуждения трансляционных исследований, но помимо этого о клиническом применении технологий регенеративной медицины и тканевой инженерии говорилось на секциях, посвященных клеточной биологии, генной терапии, биоматериалам, разработке каркасов и биореакторов, биопринтингу.
Отличительная особенность нынешнего конгресса: рекордное количество докладов, посвященных трансляционным исследованиям, внедрению фундаментальных научных результатов в клинику. По крайней мере, четыре полноценных самостоятельных секции были организованы специально для обсуждения трансляционных исследований, но помимо этого о клиническом применении технологий регенеративной медицины и тканевой инженерии говорилось на секциях, посвященных клеточной биологии, генной терапии, биоматериалам, разработке каркасов и биореакторов, биопринтингу.
Также конгресс отразил мультидисциплинарный характер регенеративной медицины и четкие связи между фундаментальными и прикладными исследованиями. Некоторые симпозиумы освещали базисные аспекты молекулярной и клеточной биологии, которые пока еще являются «открытой книгой» для исследователей. Это подтверждается интересом со стороны участников. Например, секция «Механизмы поведения стволовых клеток» собрала так много слушателей, что организаторам пришлось срочно налаживать трансляцию в двух дополнительных залах. В течение последних нескольких лет, возникло ощутимое противоречие, недостаток данных, связанных с механизмом действия клеточной терапии при использовании плюрипотентных взрослых стволовых клеток. На этой секции, организованной при содействии REMEDIC, было представлено три очень сильных сообщения ведущих экспертов со свежими результатами в этом направлении: Paolo Bianco (Sapienza University of Rome, Italy), Frank Luyten (Division of Skeletal Tissue Engineering, KULeuven, Belgium), Katarina Le Blanc (Karolinska Institute, Sweden).
Пояснение: REMEDIC - Research Networking Program – это Исследовательская объединяющая программа Европейского научного фонда (European Science Foundation). Ее цель – стимулировать обмен идеями между исследователями, работающими в различных областях регенеративной медицины.
“Клеточная терапия с применением мезенхимальных стволовых клеток: текущее состояние и перспективы развития»: на этом симпозиуме были представлены исследования, проводимые сегодня как в фундаментальных научных лабораториях, так и в различных корпорациях, которые стремятся ликвидировать барьер, выстроить линию от механизма действия - к результату и наоборот при использовании мезенхимальных клеток для лечения различных заболеваний и повреждений. TERMIS и соорганизатор симпозиума, Международное общество клеточной терапии, объединили усилия, чтобы представить последние достижения и перспективы в использовании мезенхимальных клеток для восстановления тканей и иммуномодуляции. Докладчики сделали акценты на следующие аспекты проблемы: путях оптимизации условий для трансдифференцировки данного типа клеток, а также – безопасности клинического применения хондроцитов. Два ключевых доклада были посвящены недавним работам по клеточной терапии при неврологических повреждениях, использованию мезенхимальных клеток для иммуномодуляции и контролю за доставкой клеток в пораженные области.
Концепция тканевой инженерии в регенеративной медицине подчиняется мультикомпонентной стратегии, предусматривающей одновременное использование клеток и различных биоматериалов. Было показано, к примеру, что наличие матрикса, воссоздающего живую среду ткани, включая ее строение, пространственную структуру, текстуру, механические свойства, является ключевым для поведения клеток, их миграции, жизнеспособности и возрождения их естественных функций в данном виде ткани. Клетки и матрикс натурального происхождения (особенно – человеческой плаценты и амниотической оболочки плода) отвечают этим критериям и могут использоваться для стимуляции регенерации ткани. В докладах, представленных на секции «Внеклеточные матриксы и клетки из натуральных источников», оценивались свойства и возможности данных биоматериалов стимулировать процессы заживления и регенерации ткани.
Значительное место в программе конгресса (несколько секций в течение двух дней) было отведено докладам, посвященным главным инструментам регенеративной медицины – технологиям создания биоматериалов, каркасов, биореакторов. Биоматериалы, после собственно клеток, являются ключевым элементом для создания искусственного органа, ткани. Они могут способствовать или наоборот препятствовать взаимодействию клеток, доставлять лекарства в нужный участок, и вообще управлять процессами регенерации, происходящими внутри тела пациента. Сотни лабораторий в мире заняты созданием и усовершенствованием материалов с заданными специфическими свойствами. Результаты последних исследований были представлены на симпозиуме «Биоматериалы для регенеративной медицины».
Представительная секция “3D Каркасы/Клеточный принтинг», собравшая признанных лидеров в этой области, была посвящена технологическим аспектам разработки каркасов для различных органов и развития подходящих биоматериалов для изготовления каркасов. Наибольшее количество вопросов и дискуссию вызвали следующие доклады: «Конструирование многоуровневых эластичных 3D каркасов при помощи лазера» (Ovsianikov A, Dado-Rosenfeld D, Nurnberger S, Levenberg S, Redl H, Liska R, Stampfl J, Inst. of Materials Science and Technology TU Wien, Austria) и «Бескаркасное биоконструирование» (Marga F, Jakab K, Norotte C, Khatiwala C, Shepard B, Dorfman S, Colbert S, Hubbard B, Forgacs G, University of Missouri, USA).
 Примеры применения этих технологий в клинике и дальнейшего развития уже на основании клинических результатов были представлены учеными из всемирно известного Института регенеративной медицины Wake Forest в США. Их доклад назывался «Развитие и внедрение комплексных систем биопринтинга органов» (Kang HW, Kengla C, Lee SJ, Atala A, Yoo J, Wake Forest Institute for Regenerative Medicine). А также – Лондонского Империал Колледжа (Новые стратегии в регенеративной медицине, основанные на применении различных материалов, Stevens M.).
Примеры применения этих технологий в клинике и дальнейшего развития уже на основании клинических результатов были представлены учеными из всемирно известного Института регенеративной медицины Wake Forest в США. Их доклад назывался «Развитие и внедрение комплексных систем биопринтинга органов» (Kang HW, Kengla C, Lee SJ, Atala A, Yoo J, Wake Forest Institute for Regenerative Medicine). А также – Лондонского Империал Колледжа (Новые стратегии в регенеративной медицине, основанные на применении различных материалов, Stevens M.).
Культивирование трехмерных тканевых конструкций в биореакторе позволяет контролировать условия среды, в которой находятся клетки, что дает возможность поддерживать рост ткани, сохранять ее жизнеспособность, индуцировать и поддерживать дифференцировку. Чтобы добиться воспроизводимых условий для культивации клеток за процессом культивирования надо постоянно наблюдать и контролировать его. Блоки контроля и сенсорные системы позволяют отслеживать в режиме реального времени рост ткани и получать данные для создания воспроизводимых протоколов культивирования. Все большая автоматизация этого процесса может быть достигнута за счет «уложения» природных биологических реакций во всем их многообразии в стандартизированные процедуры высокопроизводительного генерирования тканей. Секция «Автоматизация технологии биореакторов для 3D тканевых культур» была посвящена достижениям и нерешенным пока проблемам, которые возникают, когда индивидуальный процесс культивирования, контролируемый вручную, превращается автоматизированную и воспроизводимую процедуру культивирования для тканевой инженерии.
На симпозиуме «Биореакторы для трансляционных исследований» был сделан акцент на исследования по разработке и использованию биореакторов для культивирования клеток человека и животных и конструирования тканей для трансляционной медицины. Главные «горячие точки»: создание тканевых конструкций для имплантации, с использованием стволовых, прогениторных, дифференцированных клеток – как на основе биоинженерных каркасов, так и без них; изучение различных заболеваний с использованием биореактров с клеточными тканеинженерными конструкциями; изучение свойств стволовых клеток с использованием биореакторов, включая дифференцировку, размножение, распространение и характеристики способности к дифференциации. На симпозиуме были представлены сообщения высокого качества от исследователей, работающих в различных областях, как в фундаментальной, так и в прикладной сфере, а также представляющих технологические разработки, которые могут предложить лучшие решения для создания тканеинженерных конструкций и тем самым ускорить трансляционные исследования.
Большое число представленных работ, связанных с трансляцией достижений фундаментальной науки в клинику, как уже отмечалось, было главной особенностью конгресса в Вене. Каждый пример клинического применения является результатом симбиоза клеточной терапии, тканевой инженерии и применения более качественных биоматериалов. Однако помимо этого, для создания различных видов тканей и органов требуется разработка различных подходов, комбинаций этих средств и методов, применение различных видов материалов. С примерами воплощения этих различных подходов можно было познакомиться на секциях, посвященных созданию конкретных тканей и органов. Большая часть работ (несколько секций) была посвящена тканевой инженерии кожи и костных имплантатов. Очень подробно об этом написали наши коллеги из Института стволовых клеток человека в материале «Костный срез», размещенном на их сайте (также читайте там блоги, посвященные конгрессу).
Огромный прогресс также достигнут в изучении процессов васкуляризации, и в регенерации сосудов, нервной ткани, разрабатываются различные подходы к регенерации печени, легкого, сердца. Мы же отметим секцию, председателем и одним из организаторов которой был член нашей исследовательской группы Гранта Правительства РФ Филипп Юнгеблат – «Трахея/Пищевод/Органы дыхания – восстановление и замена».

 Как доброкачественные, так и онкологические заболевания, приводящие к повреждению органов и тканей грудной клетки, обычно лечатся хирургически, когда поврежденный участок или орган удаляется. Однако большая часть случаев к моменту постановки диагноза являются неоперабельными. Для разработки методов лечения требуются новые решения и подходы. В данном случае ставка делается на тканевую инженерию и методы регенеративной медицины в целом, и уже были достигнуты впечатляющие результаты, которые демонстрируют огромный потенциал этих методов, в частности – для «выращивания» трахеи. Филипп Юнгеблат (Philipp Jungebluth, Karolinska Institute, Sweden), сотрудник лаборатории профессора Paolo Macchiarini, выступил с докладом, где были представлены одновременно клинические результаты (трансплантации трахеи 12 пациентам, с использованием различных методик и подходов), а также – подробный анализ этих случаев, который дает возможность делать обобщения о тенденциях тканевой инженерии в целом. Перевести название можно так: «Тканевая инженерия: от лабораторного стола - к постели больного и обратно в лабораторию»
Как доброкачественные, так и онкологические заболевания, приводящие к повреждению органов и тканей грудной клетки, обычно лечатся хирургически, когда поврежденный участок или орган удаляется. Однако большая часть случаев к моменту постановки диагноза являются неоперабельными. Для разработки методов лечения требуются новые решения и подходы. В данном случае ставка делается на тканевую инженерию и методы регенеративной медицины в целом, и уже были достигнуты впечатляющие результаты, которые демонстрируют огромный потенциал этих методов, в частности – для «выращивания» трахеи. Филипп Юнгеблат (Philipp Jungebluth, Karolinska Institute, Sweden), сотрудник лаборатории профессора Paolo Macchiarini, выступил с докладом, где были представлены одновременно клинические результаты (трансплантации трахеи 12 пациентам, с использованием различных методик и подходов), а также – подробный анализ этих случаев, который дает возможность делать обобщения о тенденциях тканевой инженерии в целом. Перевести название можно так: «Тканевая инженерия: от лабораторного стола - к постели больного и обратно в лабораторию»
Столь сложная и многодисциплинарная отрасль науки и медицины требует обобщения, аналитической работы, описания тенденций, прогнозов. Эту сложную задачу на конгрессе попытались решить в той или иной степени пленарные докладчики. Несколько слов о каждом:
Dietmar W. Hutmacher (Professor and Chair of Regenerative Medicine, Institute of Health and Biomedical Innovation of QUT). Возглавляет мультидисциплинарную группу исследователей, куда входят клеточные биологи, химики-специалисты по полимерам, инженеры, врачи и ветеринарные хирурги. Его группе удалось сформировать костную ткань и кость, которая способна заменить поврежденную с практически полным восстановлением функций. Концепция костной тканевой инженерии, разработанная группой профессора Хатмахера, дает возможность заменять точно определенные участки костной ткани и создать более действенные альтернативные способы лечения в ортопедии – не срастающиеся переломы, исправление сегментарных дефектов большого размера. Другой важный проект профессора и его группы – создание животных моделей для разработки методов восстановления кости.
(Пленарные дебаты «Будущее научных изданий»)
David Kaplan (Professor & Chair of the Department of Biomedical Engineering, School of Medicine, School of Dental Medicine, Department of Chemistry, Department of Chemical and Biological Engineering (Tufts University). Его исследования посвящены созданию биополимерных конструкций для тканевой инженерии и изучению структурно-функциональных взаимодействий. Он управляет специально созданным для этой цели Ресурс-Центром Тканевой Инженерии ( Tissue Engineering Resource Centre (TERC), включающим лаборатории двух американских университетов – Тафт и Колумбийского (Tufts University, Columbia University).
(Лекция «Изучение моделей заболеваний человека с помощью тканевой инженерии» )
Ivan Martin (Director of the Tissue Engineering Research Group, Professor for Tissue Engineering, Faculty of Medicine Departments of Surgery and of Biomedicine, University of Basel). Его группа, сосредоточенная в швейцарском Базеле, опять-таки состоит из биологов, инженеров и клиницистов, что позволяет проводить междисциплинарные исследования с упором на клинику. Основной интерес: 3D системы культур мезенхимальных клеток различных органов, используемые в качестве моделей для изучения дифференцировки клеток и развития тканей, а также – в качестве каркасов для восстановления кости и хряща.
(Лекция «Сдвиги парадигмы. Эволюция стратегий тканевой инженерии»)
Shinichi Nishikawa (Director of the laboratory for Stem Cell Biology at RIKEN Centre for Developmental Biology, Deputy Director of CDB, Japan). Основной научный интерес группы, которую в данный момент возглавляет этот японский ученый, заключается в исследовании молекулярных и клеточных механизмов, управляющих развитием гематопоэтических стволовых клеток. Он внес весомый вклад в различные области, с которыми соприкасался и является одним из ведущих клеточных биологов в мире.
(Лекция «Преодоление проблем клеточной терапии на основе iPS клеток: Японский национальный проект реализации регенеративной медицины»).
Clemens A. van Blitterswijk (Professor of Tissue Regeneration at Twente University, Netherlands). Большая часть его исследований проводится на стыке наук о жизни и наук о материалах, формируя уникальную междисциплинарную основу для регенеративной медицины. Сейчас он возглавляет одну из ведущих европейских лабораторий в этой сфере, он также является научным директором MIRA, недавно созданного института биомедицинских технологий, где после окончательного формирования будет работать около 400 исследователей.
(Вторая лекция из серии «Сдвиги парадигмы» - «Высокопроизводительный инструмент для тканевой инженерии»)
David Williams (Wake Forest Institute of Regenerative Medicine, USA). Этот исследователь широко известен своим коллегам в том числе и как главный редактор одного из ведущих научных изданий данной области - Biomaterials. У него 40-летний опыт работы в сфере разработке биоматериалов, медицинской техники и тканевой инженерии. Уже будучи опытным ученым он покинул Университет Ливерпуля, где возглавлял отдел клинической инженерии, и переехал в Штаты, в Институт регенеративной медицины Wake Forrest, который является одним из мировых лидеров в этой области сегодня.
(Пленарные дебаты «Будущее научных изданий»)
Большинство участников конгресса так или иначе сталкиваются с проблемой законодательного и этического регулирования исследований. Регенеративная медицина – очень молодая отрасль (к примеру, научная ассоциация TERMIS была создана менее 10 лет назад), и поэтому пока еще законы и инструкции в различных странах сильно отличаются. Организаторы проиллюстрировали эту проблему на специальной секции, где главными докладчиками были представители ведущих «регулирующих» организаций – FDA (США) и Европейское медицинское агентство (EMEA). Они представили доклад «Регуляторная практика в сфере регенеративной медицины в Европе и США» и продемонстрировали сходства и различия. Вывод был схожим: поскольку регенеративная медицина – интернациональная область исследований, в которой работает все больше транснациональных корпораций, необходимо унифицировать регуляторные нормы, по крайней мере, в США и Европе.
И еще одна особенность венского конгресса – средний возраст участников, как, впрочем, и возраст самой отрасли, очень невелик. Тридцатилетние представляют полноценные пленарные доклады, а сорокалетние уже стали полноправными наставниками и приехали на конгресс со своими учениками. Для студентов была организована специальная секция и учреждена премия за лучший доклад. Вместе со своими руководителями они выступали в качестве ведущих и председателей на секциях и симпозиумах. Энтузиазм, желание работать и узнавать новое поражает. В любое время, будь это 8 утра или 8 вечера, все шесть залов Дворца Хофбург, где проходили заседания, были полны.
Следующий, четвертый по счету, TERMIS World Congress, состоится в сентябре 2015 в Бостоне (США).
Третий Всемирный Конгресс TERMIS «Тканевая инженерия и регенеративная медицина» состоится в Вене 5-8 сентября 2012 г. TERMIS – основное место встречи международного научного сообщества - специалистов в области регенеративной медицины.
Основные цели проведения конгресса:
- обсуждение переводных аспектов тканевой инженерии и регенеративной медицины;
- продвижение молодых исследователей;
- взаимодействие с другими сообществами в области важных аспектов регенерации ткани;
- создание платформы для плодотворного сотрудничества между промышленностью и наукой.
http://www.wc2012-vienna.org
 В Эдинбурге открылся один из крупнейших в Европе центров регенеративной медицины. На его строительство было потрачено 54 млн. фунтов стерлингов.
В Эдинбурге открылся один из крупнейших в Европе центров регенеративной медицины. На его строительство было потрачено 54 млн. фунтов стерлингов.
Шотландский центр регенеративной медицины (Scottish Centre for Regenerative Medicine, SCRM) открылся в Эдинбурге 28 мая торжественной церемонией с участием принцессы Анны. Центр регенеративной медицины будет проводить исследования на переднем крае науки с целью изучения возможностей стволовых клеток для терапии таких заболеваний как болезнь Паркинсона и другие нейромоторные дискинезии, рассеянный склероз, а также болезни печени и сердечно-сосудистой системы. В центре будут работать 250 специалистов-биологов и около 100 человек обслуживающего персонала.
76 процентов энергии, которая необходима для работы Центра, будет поступать из возобновляемых источников. Строительство Центра обошлось в 54 миллиона фунтов стерлингов – здание, построенное по уникальному архитектурному проекту, занимает площадь в девять тысяч квадратных метров. Оно расположено в так называемом "биоквартале"(BioQuarter) Эдинбурга, районе, где сосредоточены биологические исследовательские лаборатории королевского Центра медицинских исследований (Medical research Centre), неподалеку от Рослинского института, в котором в 1997 году было клонировано первое млекопитающее, овца Долли.
По словам директора Центра Чарльза Френч-Константа (Charles French-Constant), "это место должно стать магнитом для притяжения новых поколений биологов". Он добавил также, что последние исследования в области стволовых клеток знаменуют собой начало революции в современной медицине. Наряду с исследованиями терапевтических возможностей стволовых клеток в Центре будут отлаживаться механизмы принципиально новой, трансляционной, медицины, которая предлполагает тесное взаимодействие ученых с клиницистами, призванное ускорить внедрение научных результатов в медицинскую практику.
Одновременно с главным зданием Центра Её Королевское Высочество открыла биоинкубатор под названием Nine – установку стоимостью в 24 миллиона фунтов стерлингов, расположенную на площади семи с половиной тысяч квадратных метров. Эта установка – совместное детище шотландского и британского правительств.
Источник
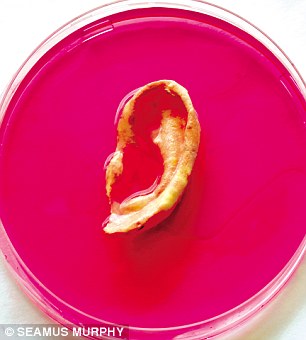 Группа исследователей Отделения Нанотехнологий и регенеративной медицины Лондонского университетского колледжа, возглавляемая профессором Александром Сейфальяном (Alexander Seifalian) заявила, что готова выращивать органы по заказу, используя собственные клетки пациента.
Группа исследователей Отделения Нанотехнологий и регенеративной медицины Лондонского университетского колледжа, возглавляемая профессором Александром Сейфальяном (Alexander Seifalian) заявила, что готова выращивать органы по заказу, используя собственные клетки пациента.
«Это нос, который мы выращиваем для пересадки пациенту в следующем месяце», - говорит профессор Александр Сейфалиан (Alexander Seifalian) будничным тоном, резко поднимая чашу Петри с лабораторного стола. Внутри, в красной вязкой субстанции, плавает орган, который выглядит совсем как настоящий. Рядом стоит другая чаша, в которой плавает ухо.
«Первый в мире», - говорит он, улыбаясь. «Прежде никто не выращивал нос». В его лаборатории стоят деревянные парты, беспорядочно уставленные мензурками, сосудами с растворами, крышками, медицинскими банками, трубками и бумагами, и помещение лишь немногим отличается от школьной химической лаборатории. Однако именно отсюда профессор Сейфалиан осуществляет управление отделением Нанотехнологий и регенеративной медицины Университетского Колледжа Лондона (УКЛ), которое сам в шутку называет «магазином человеческих частей тела».
Он устраивает экскурсию по лаборатории, в ходе которой, один прорыв в области медицины поражает больше другого. С одного из столов он берет стеклянную матрицу в форме трахеи – дыхательного горла – которая была использована во время первой в мире трансплантации этого органа профессором Каролинского института Паоло Маккиарини.
На другом столе находятся ингредиенты для создания искусственного сердца, а прямо за ним - большой аппарат с бледным, словно паутина, тонким кабелем внутри, пульсирование которого напоминает сердцебиение. Это артерия.
 Три статьи, опубликованные в семействе журналов Nature в апреле 2012 года, подтвердили эффективность методов регенеративной медицины. Можно сказать, что при помощи этих методов, разным группам ученым удалось восстановить мышь «от и до». Начиная от волосяного покрова и до тканей сердечной мышцы.
Три статьи, опубликованные в семействе журналов Nature в апреле 2012 года, подтвердили эффективность методов регенеративной медицины. Можно сказать, что при помощи этих методов, разным группам ученым удалось восстановить мышь «от и до». Начиная от волосяного покрова и до тканей сердечной мышцы.
Американские ученые восстановили сердечную мышцу, получив ее клетки из соединительной ткани. Результаты этого исследования, а также двух других работ, свидетельствующие об успехах регенеративной медицины, были опубликованы в журнале Nature.
Группа специалистов Калифорнийского университета в Сан-Франциско провела серию экспериментов на лабораторных мышах, перенесших инфаркт миокарда. Инфаркт развивается в результате нарушения кровоснабжения сердца и проявляется гибелью клеток сердечной мышцы (кардиомиоцитов).
Американцы нашли способ преобразования соединительной ткани в сердечную мышцу. Соединительнотканные клетки (фибробласты) были "перепрограммированы" с помощью вирусных векторов, в результате из них развились нормальные кардиомиоциты.
Исследователи из Нью-йоркского университета в свою очередь использовали аналогичную методику, чтобы вернуть мышам зрение. Они пересадили предшественники фоторецепторных палочек мышам с наследственной патологией сетчатки. Несмотря на то, что прижились не более 15 процентов таких клеток, ночное зрение мышей значительно улучшилось.
Ученые из Японии восстановили волосяной покров мышей, использовав при этом стволовые клетки, взятые как у других грызунов, так и у человека. Из стволовых клеток исследователям удалось получить волосяные луковицы. Рост волос у лысых мышей был зафикисрован в период от двух до пяти недель после трансплантации.
http://medportal.ru/mednovosti/news/2012/04/19/regenerate/
Создание биоинженерных органов приближает нас к решению проблемы нехватки донорских органов (профессор Паоло Маккиарини и соавторы, Ланцет)
Согласно статьи в журнале Ланцет, опубликованной в начале марта 2012 года в разделе о стволовых клетках, новая технология, включающая в себя использование искусственного каркаса, куда помещаются собственные стволовые клетки пациента (что позволяет органу полноценно функционировать), могла бы явиться потенциальным решением проблемы нехватки донорских органов. Этот новейший подход к регенерации и трансплантации органов не требует доноров и иммуносупрессивных препаратов, не вызывает проблем с отторжением.
“Такой подход был уже успешно использован для реконструкции некоторых сложных тканей, например, таких органов как трахея, пищевод, скелетная мышца, у животных и человека. При соответствующем научном и этическом надзоре, такой подход стать основой для инженерии целых органов и тканей, жизнеспособным терапевтическим методом для удовлетворения потребности в органе при утрате его функции, ”- объясняет Паоло Маккиарини, профессор Каролинского Института, Стокгольм, Швеция, ведущий автор статьи.
Из-за общего старения населения усугубляется кризис нехватки донорских органов. Каждый год только в США около 120 000 людей умирают от хронических заболеваний легких, 112 000 – от почечной недостаточности, и 425 000 – от заболеваний коронарных сосудов сердца. Пациенты, которым все же посчастливилось получить донорский орган, все еще сталкиваются с пожизненной дорогой и потенциально опасной иммуносупрессивной терапией.
В данной статье профессор Маккиарини и соавторы обсуждают использование новой регенеративной технологии, основанной на применении натурального экстрацеллюлярного матрикса как биологического каркаса, дают общее представление о ключевых научных и этических проблемах, требующих решения перед более широким применением данного подхода, а также представляют обзор достижений в реконструкции органов.
Оптимальные клеточные источники для различных органов, идеальные материалы для каркасов и определение должной популяции пациентов, - вот некоторые из ключевых вопросов, к которые необходимо решить перед широким клиническим использованием.
“Для клинических исследований необходим строгий отбор кандидатов: подходящие пациенты должны быть способны дать компетентное согласие, должны обладать в некотором объеме социальной поддержкой, не должны иметь серьезной сопутствующей патологии, и должны быть готовы к потере конфиденциальности,”- отмечают авторы.
Помимо научных проблем, необходимо многое сделать для решения многочисленных этических вопросов, которые поднимает новая технология. «Необходимость совершенствования данной технологии, продиктованная спросом, погоня за престижем и потенциальной прибылью - все это требует готовности обеспечить прежде всего безопасность технологии, особенно в условиях, когда такое большое количество потенциальных пациентов и врачей с нетерпением ждут появления любого метода лечения, дающего надежду», - предупреждают Маккиарини и его коллеги.
Они призывают обратиться к следующим проблемам - прозрачности технологий, источников клеток, финансовых затрат для пациентов, их информированного согласия, стратегии работы с неудачами в эксперименте, а также оказания помощи пациентам после первоначального лечения.
«Возможно, самая важная этическая обязанность, с которой сталкивается биоинженерное сообщество, это определение критериев, которые станут основой для эволюции метода от этапа научных исследований до создания терапии».
В качестве сопровождающего комментария Дуско Илик, Медицинская Школа Королевского Колледжа, Лондон, и Джулия Полак, Имперский Колледж, Лондон отмечают: “Несмотря на то, что некоторые проблемы еще не решены, перспектива каркаса, который может быть засеян собственными стволовыми клетками, выращенными in vitro, кажется более близкой, чем можно было надеяться даже несколько лет назад”.
Паоло Маккиарини, профессор Каролинского Института, Стокгольм, Швеция. paolo.macchiarini@ki.se
Дуско Илик, Медицинская Школа Королевского Колледжа, Лондон. dusko.ilic@kcl.ac.uk
Увеличение содержания внеклеточного матрикса и изменение механических свойств тканеинженерных хрящевых конструкций при сжатии
Ученые из Калифорнийского университета выдвинули гипотезу, что включение коллагена и протеогликана в структуру синтезируемых хрящевых структур повышает их устойчивость к механической нагрузке. Целью данной работы являлось определение влияния коллагена, протеогликана или их сочетаний на способность к сжатию 2% агарозных структур и концентрацию внеклеточного матрикса, а также улучшение вышеперечисленных свойств. Включение комбинации коллагена и протеогликана в состав гидрогелевых хрящевых структур существенно улучшает способность к сжатию по сравнению с использованием только одного коллагена или протеогликана. Полученные результаты подтверждают концепцию синтеза хрящевых структур с включением комбинации коллагена и протеогликана для улучшения механических свойств и способности к сжатию хрящевой ткани.
http://online.liebertpub.com/doi/abs/10.1089/ten.TEA.2011.0300?elq=7c3e9838d6b34dce8303e9490bbf0a55
Гидрогель, полученный из децеллюляризованного экстрацеллюлярного матрикса желудочков сердца, повышает жизнеспособность кардиомиоцитов и предупреждает повторные инфаркты миокарда
В журнале «American College of Cardiology» сообщается об исследовании, в котором оценено использование инъекционных форм гидрогеля, полученного из внеклеточного матрикса желудочков сердца, для лечения инфаркта миокарда при подкожном введении. Гидрогель, тропный к миокардиоцитам, получен от самок крыс, подвергнутых воздействию реперфузионной ишемии в результате введения гидрогеля или солевого раствора. Гидрогель доставлялся опосредованно через катетер фирмы MyoStar (Калифорния). На модели инфаркта миокарда у крыс было установлено, что инъекция исследуемого вещества увеличивает количество эндогенных кардиомиоцитов в зоне инфаркта и поддерживает функции сердца без развития аритмии. Полученные результаты требуют дальнейшего изучения с привлечением большего числа животных и позволяют считать данный метод перспективным в лечении инфаркта миокарда.
Биомеханические и ангиогенные свойства тканеинженерной трахеи крысы, полученной при использовании децеллюляризованной ткани с генными модификациями
Как сообщает журнал «Биоматериалы», в исследовании итальянских ученых, возглавляемых профессором Паоло Маккиарини, описано получение и характерные свойства децеллюризованного каркаса трахеи крысы. Для получения подобной трахеи, пригодной для изучения свойств каркаса, использовались те же ферментноопосредованные методы, что и при получении биоинженерных каркасов трахеи свиней и человека. В исследовании продемонстрировано, что после 9 циклов ферментной обработки происходит полное освобождение каркаса от клеток, при этом сохраняются механические свойства и васкуляризация, присущие нативным тканям. Более того, для улучшения механических свойств ткани децеллюляризованной трахеи использовался генипин, считающийся естественным наследуемым фактором генной модификации. Продемонстрировано, что при использовании данного препарата увеличивается механическая прочность ткани без повреждения проангиогенных свойств децеллюляризованного матрикса тканей дыхательных путей и без развития иммунного ответа.
http://www.sciencedirect.com/science/article/pii/S0142961211012117
Использование человеческих стволовых клеток, полученных из железистой ткани, для улучшения васкуляризации при регенерации кожи
По сообщению журнала «Исследовательская дерматология», стволовые клетки, выделенные из потовых желез человека, помещались на коллагеновые каркасы и прививались мыши для активации процесса регенерации кожи при замещении тканевого дефекта. Было показано, что эти клетки быстро увеличивают свое число и вырабатывают большое количество маркеров дифференцировки стволовых клеток. Более того, клетки улучшают ангиогенез путем образования капилляроподобных структур. После помещения клеток на каркасы, они размещались гомогенно, взаимодействуя с подложкой и выделяя биологически активные вещества для активации процессов ангиогенеза, иммунного ответа и ремоделирования тканей. Так как из потовых желез легко получить аутологичные стволовые клетки, легко поддерживать пролиферацию, экспоненцию и васкуляризацию культуры клеток, было предложено использовать их при дальнейших клинических исследованиях.
Развитие коры головного мозга человека от плюрипотентных стволовых клеток до функционально активных синапсов возбуждения
Согласно журналу Nature Neuroscience, ученым удалось воссоздать полноценный пошаговый процесс развития коры головного мозга человека из плюрипотентных клеток: от направленной дифференцировки эмбриональных стволовых и индуцированных плюрипотентных клеток в кортикальные стволовые и прогениторные клетки с последующим пролонгированным нейрогенезом до нейральной терминальной дифференцировки клеток, приобретающих электрофизиологические свойства зрелых клеток и проводящих нервный импульс синаптических контактов. Было установлено, что индукция кортикальных нейроэпителиальных стволовых клеток из эмбриональных стволовых клеток и индуцированных плюрипотентных клеток повторяет in vivo процесс развития кортикальных нейронов с соблюдением временной последовательности. Это позволяет проводить функциональные исследования развития коры головного мозга и создание кортикальной сети нейронов ex vivo при моделировании картины болезней в терапевтических целях.
http://www.nature.com/neuro/journal/v15/n3/full/nn.3041.html
 Главная страница
Главная страница